효소반응속도론
효소반응 속도론
효소의 활성은 효소농도, 기질농도, 기질이 효소작용을 받는 난이성, 조효소의 농도, allosteric effect, 저해물질의 존재와 그의 농도나 형태, 이온 강도, pH, 온도, 반응개시 후의 시간 등에 지배된다. 이 지표들이 각각 어떻게 효소 활성에 영향을 주는 가를 아는 것이 효소 반응속도론이다. 기본적인 효소 화학반응의 6가지 type은 다음과 같다.
- Oxidoreductase : 수소이온 혹은 전자를 전달하여 기질을 산화 혹은 환원시킴.
- Transferase : 기질의 특정 group을 다른 기질로 전달시킴.
- Hydrolase : Ester, peptide, ether 결합 등을 가수분해함.
- Lyase : 이중결합에 원자group을 가하거나, 두 group을 제거해 이중결합을 형성함.
- Isomerase : 화학식은 같으나 다른 구조인 이성질체로 전환함.
- Ligase : 두개이상의 분자를 공유결합 시킴.
효소의 6가지 type 중에서 isomerase를 제외하고는 효소의 기질이 두 종류인 것을 알 수 있다. 그러나 효소반응 mechanism은 단일 기질의 경우를 대상으로 설명하는 경우가 많으며, 이는 두 가지 종류의 기질 중 한 가지의 농도를 일정하게 유지하고 다른 한 가지 기질의 농도를 변화시키는 실험이 주로 이루어지기 때문에 기질이 두 가지인 효소반응에도 적용할 수 있다.
1) Michaelis-menten의 이론
1913년 Michaelis와 Menten은 효소반응속도에 관한 이론을 발표하였다. 그들에 의하면 기질(S)이 효소에 의해 생성물(P)로 변화되는데는 우선 효소(E)와 기질사이에 효소-기질 복합체(E-S Complex)를 생성하고 이것이 반응생성물과 유리의 효소로 해리되며 그 효소는 다시 미반응의 기질에 결합하여 같은 반응계를 반복하게 된다는 것이다.

반응의 평형상태에는 ES의 분해속도와 생성속도가 같으므로 다음의 관계가 성립하고
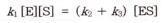
따라서 다음의 두 식이 성립한다.
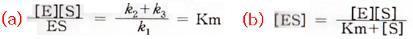
식(a)에서 Km을 일반식으로 Michaelis정수라고 한다. ES Complex의 생성속도가 분해속도에 비해 현저히 큰 경우 반응속도(V)는 V=k3[ES]로 주어지며, S가 포화농도에 있는 반응의 최대초속도(Vmax)는 전효소량에 비례한다. 즉 Vmax==k3[E]로 된다. 일반적으로 어느 [S]에 있는 속도 V와 [S]→∞(포화상태)에 있어서의 최대속도 Vmax와의 관계는 다음 식으로 나타낸다.
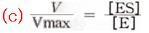
식(b)와 식(c)에 의해 (d)식이 성립하고 이 식을 Michaelis-Menten식이라고 하며 다음의 그래프와 같이 나타낸다.
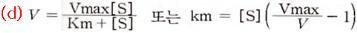
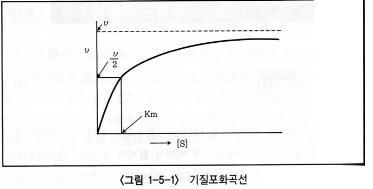
Lineweaver와 Burk는 이 Michaelis-Menten식을 변형하여 식(e)를 얻었으며, 이것이 더 정확하고 용이하다.
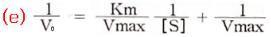
기질농도를 여러 가지로 하여 반응속도를 구하고 그 역수를 plot하면 다음 과 같은 그래프가 나타난다.
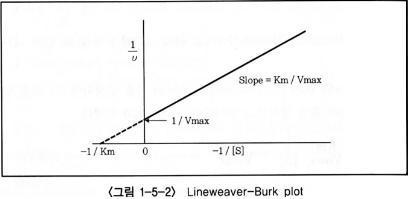
이 그래프에서 나타난 바와 같이 Km 및 Vmax의 수치는 얻어진 직선을 연장하여 교차하는 점에서 구한다.
2) 효소 반응속도론에서 영향을 주는 인자
- 저해제
효소의 어느 특정부위에 결합하여 반응속도를 저하시키는 물질을 저해제라고 한다. 저해제에는 효소의 기질과 구조가 유사하여 기질이 효소와 결합하는 부위에 기질과 경쟁적으로 결합하는 경쟁적 저해제, ES Complex에 결합하여 효소활성을 저해하는 비경쟁적 저해제, 기질 결합부위와 다른 부위에 결합하여 효소활성을 저해하는 무경쟁 저해제가 있다.
- pH와 온도
효소반응에는 최적 pH가 존재한다. 일반적으로 최적 pH는 7.0 근처에 있지만 pepsin과 같이 산성에서 안정한 것도 있다. 이 효소의 pH의존성은 효소가 단백질로서 강산성이나 강알칼리성에는 활성기 부근의 구조가 변화하여 ES복합체의 형성이 불가능하게 되므로 효소는 활성을 잃는다.
pH와 마찬가지로 효소에는 최적 온도라 할 수 있는 상태가 있다. 동물의 경우 보통 30~40℃이다. 효소반응은 보통 20℃, 25℃, 37℃에서 측정되며, 45℃이상의 온도에서는 반응속도가 급격히 하락한다. 이것은 열에 의한 변성으로 구조가 변화되었기 때문이다. 일반적으로 0~37℃의 범위에서 10℃ 상승하는 사이의 속도 증가비를 Q10(온도계수)라고 하며, 그 값은 2~3이다.
- 효소 및 기질의 농도
기질이 충분한 양이 있을 때에는 효소량의 증가에 따라 동시에 ES Complex가 많이 만들어지기 때문에 반응속도가 직선적으로 증가한다. 반대로 효소의 양이 일정하고 기질의 양이 증가한다면 어느 점까지는 직선적으로 반응속도가 증가하지만 그 이후로는 일정하게 유지된다. 이 현상은 효소의 활성중심에 기질이 붙는데, 기질의 양이 많다면 동시에 그 이상의 ES Complex가 만들어지지 않기 때문이다.